Sei uscito con successo.
Non sei ancora registrato?
Regolamenti sui dispositivi medici
Informazioni relative al Regolamento sui dispositivi medici
Il nuovo Regolamento europeo sui dispositivi medici (MDR) con molte nuove regole rappresenta una sfida per tutti i soggetti coinvolti. B. Braun si sta preparando intensamente e desidera applicare i nuovi requisiti il prima possibile. Qui abbiamo raccolto per voi alcune informazioni sull'MDR.
Sei un operatore sanitario?
Cliccando 'Confirm" dichiari di essere un operatore sanitario.
Se sei un paziente o un giornalista visita le pagine a te dedicate.
Conferma Sì, sono un operatore sanitario. Cancella No, non sono un operatore sanitario.Il nuovo Regolamento europeo sui dispositivi medici (MDR) è entrato in vigore a maggio 2017. Il nuovo regolamento sostituisce la Direttiva sui dispositivi medici (MDD) e la Direttiva sui dispositivi medici impiantabili attivi (AIMDD).
Circa 500.000 dispositivi medici in Europa saranno ricertificati in conformità alla nuova politica sostanzialmente più completa per ricevere il marchio CE. Secondo le stime attuali, circa il 65% dei dispositivi medici sarà certificato secondo il nuovo regolamento. Alcuni organismi notificati sono ancora in fase di designazione e non è completamente chiaro quanti organismi notificati saranno in grado di concludere il processo (elenco sul sito web della Commissione europea ). A causa dell'aumento dei requisiti imposti agli organismi notificati e ai produttori, sono previsti e inevitabili adeguamenti del portafoglio.
Tempistica di implementazione di MDR in B. Braun
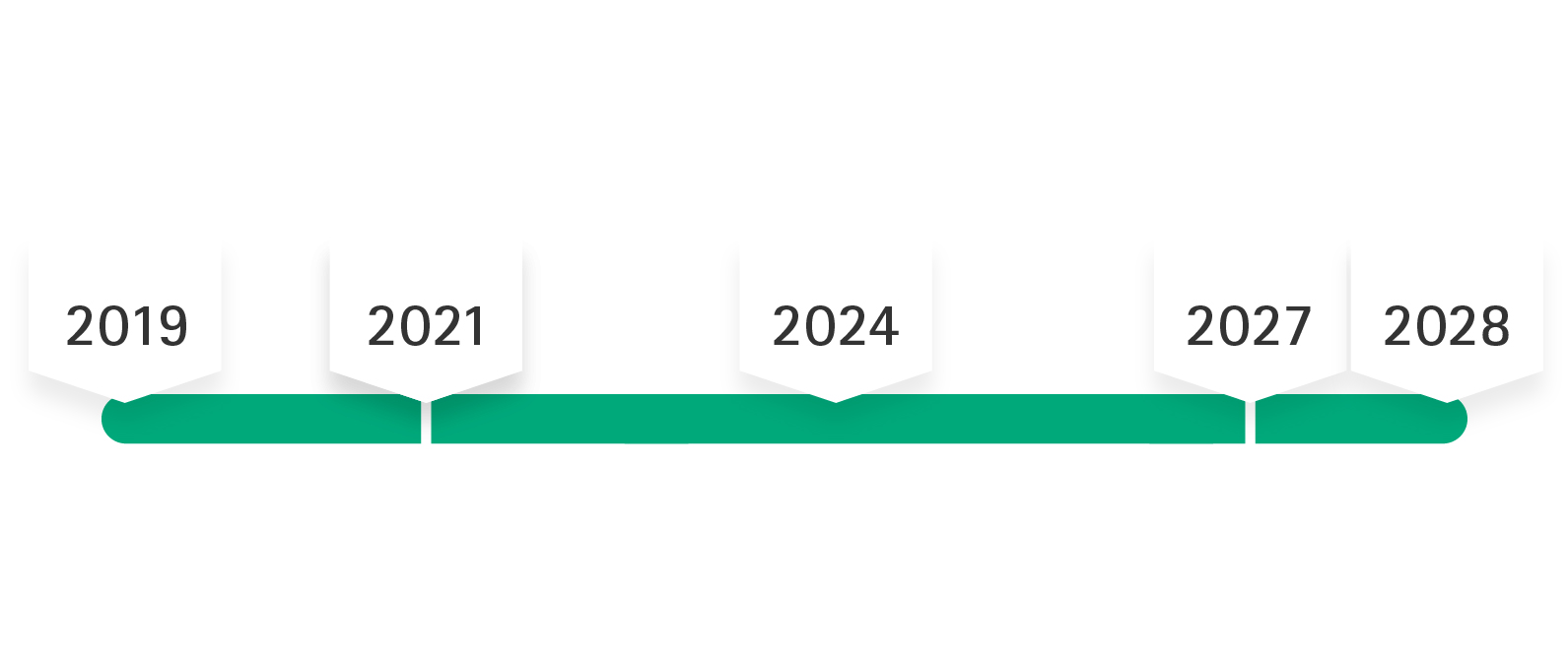
26 maggio 2024
I prodotti devono avere un'applicazione MDR firmata (ad eccezione dei prodotti MDD che stanno per esaurirsi)
3/6
Maggio 2021 - Maggio 2028
Certificato MDD "Periodo di tolleranza": Nessuna modifica di progettazione per i prodotti certificati MDD
5/6
Fino al 2027/2028
I certificati MDD mantengono la validità (la tempistica dipende dalla classe di rischio del prodotto)
6/6
Quali aree normative sono interessate?
Tra le altre cose, queste aree sono interessate:
- Regole di classificazione: le regole sono state estese per includere strumenti di Classe Ir (strumenti chirurgici invasivi riutilizzabili). I requisiti relativi ai prodotti impiantabili di Classe llb sono aumentati. Sono state introdotte nuove classi di rischio per diverse categorie di prodotti, il che potenzialmente comporta l'upclassificazione dei prodotti.
- Evidenze cliniche: in futuro, tutti i dispositivi medici sono soggetti a un obbligo di valutazione clinica indipendentemente dalla classe.
- Procedure di verifica (scrutiny - procedura di consultazione): i nuovi dispositivi impiantabili di Classe III e i dispositivi attivi di Classe II che somministrano e/o rimuovono medicinali devono essere controllati in modo più severo prima dell'ingresso sul mercato.
- Organismi notificati: i requisiti posti agli enti notificati sono in aumento. Allo stesso tempo, in futuro saranno obbligati a eseguire audit senza preavviso presso i produttori.
- Documentazione tecnica: la documentazione dovuta all'MDR aumenta notevolmente il carico di lavoro dei produttori.
- EUDAMED: è stato introdotto un database elettronico per il monitoraggio del ciclo di vita del prodotto.
Quali sono le sfide?
Al fine di garantire una fornitura continua con tecnologie mediche sicure e innovative, tutti i produttori si trovano ad affrontare il difficile compito di superare i crescenti requisiti necessari per ricevere il marchio CE. Gli enti notificati devono gettare le fondamenta e creare una capacità sufficiente per la procedura di valutazione della conformità.
Da tempo B. Braun ha iniziato a implementare la certificazione dei propri dispositivi medici in conformità all'MDR. Naturalmente, questo vale per tutti i prodotti che B. Braun produce e acquista come prodotti commerciali per completare il proprio portfolio. In relazione all'avanzamento delle misure adottate, B. Braun è sicura di poter soddisfare i requisiti dell'MDR fino a maggio 2024.
Domande frequenti sull'MDR
Domande frequenti su MDR e B. Braun
Scopri di più
Ecco una raccolta di link utili a informazioni sui siti web ufficiali della Commissione europea e su altre fonti.
-
Scheda informativa per i professionisti sanitari (sito web dell'UE)
link
-
EU-Giornale: Regolamenti sui dispositivi medici
link
-
Elenco degli organismi notificati (UE)
link
-
Cronologia EUDAMED (UE)
link
-
B. Braun Istruzioni per l'uso elettroniche (eIFU)
link
-
Scheda informativa B. Braun sull'MDR
pdf, 53.6 KB
-
Domande e risposte sugli aspetti pratici delle disposizioni di transizione all'MDR
link
Restate connessi con My B. Braun
Con il tuo account personalizzato, la tua esperienza online sarà più facile, più comoda e più sicura.